Reconstrucción con autoinjerto de peroné libre vascularizado
Espinosa de los Monteros Kelley Ana Fernanda*, Navarro Becerra Eduardo *, García Novoa Aldo Damián*
*Especialista en Cirugía de mano, microcirugía, plexo braquial y nervio periférico. Fundadora del centro de cirugía ortoplástica en Guadalajara, Jalisco, México. Especialidad en Traumatología y ortopedia. IMSS CMNO Universidad de Guadalajara (UdeG)México.
* Especialista en Cirugía de mano, microcirugía, plexo braquial y nervio periférico. Fundador del centro de cirugía ortoplástica en Guadalajara, Jalisco. México. Especialidad en Cirugía plástica, estética y reconstructiva. Especialidad en cirugía general. Universidad Nacional Autónoma de México (UNAM)
*Especialidad en Traumatología y ortopedia. IMSS HGR 45. Universidad de Guadalajara, México.
Resumen
Las fracturas diafisarias de húmero representan del 3-4% de las fracturas, las cuales pueden ser resueltas ya sea con tratamiento conservador o quirúrgico. Dentro de las opciones quirúrgicas se encuentran el clavo centromedular anterógrado de húmero rimado y no rimado, placa LCP (Low Contact Plate) rectas, proximales o distales anatómicas, placas DCP (Dynamic Compression Plate) angostas y fijadores externos. La incidencia de no-unión aséptica en este tipo de fracturas es de hasta el 12 %, los cuales pueden tratarse dando estabilidad por otro tipo de fijación, corticotomía y aplicación de injerto, depende si el problema es la estabilidad, vascularización o ambos, de esta forma llegan a curar del 82 hasta el 95% de estos casos. Factores de riesgo como la obesidad, infección, tabaquismo o microangiopatías pueden ser causa de fracaso al tratamiento.
Cuando esto sucede, se limita drásticamente la calidad de vida funcional del paciente y se convierte un reto para el cirujano, dentro de las opciones que podemos ofrecer debemos tener en cuenta la reconstrucción del miembro torácico antes de pensar en alguna técnica de salvamento.
Presentamos un caso de reconstrucción de húmero con un gran defecto óseo por no-unión aséptica y atrófica de más de 7 años de evolución donde se reseca todo el hueso no viable y se trasplanta injerto de peroné vascularizado por medio de anastomosis arteriovenosa peroneo-braquial y fijación con placa LCP proximal de húmero larga, así como la descripción de la técnica quirúrgica como referencia para cirujanos que se enfrenten a este tipo de casos.
Palabras clave: Injerto autólogo de peroné libre vascularizado, no-unión aséptica de húmero, gran defecto óseo, fractura multitratada.
Abstract
Diaphyseal humerus fractures account up to 3-4% of all fractures, which can be solved whether with conservative or surgical treatment. Between the surgical options available are antegrade reamed and unreamed intramedular humeral nail, LCP (Low Contact Plate) straight, proximal or anatomical distal plates, DCP (Dynamic Compression Plate) narrow plates and external fixator. Incidence of aseptic non-union in this type of fractures is up to 12%, which can be treated providing stability by any other kind of fixation, corticotomy and the use of graft application, depending if the issue to address is stability, vascularity or both of them. This patients heal from 82 to 95% of the cases. Risk factors such as obesity, infection, smoking or microangiopathies could be the cause of failure in treatment.
When this take place, drastically confines the functional quality of life of the patient and becomes a real challenge for the surgeon, within the options that we are able to provide we must keep in mind the upper limp reconstruction before thinking in any other salvage surgical technique.
We are presenting a humeral reconstruction case with a great bony defect with aseptic and atrophic non-union of 7 year evolution background where we excised the whole non-viable bone and we transplanted vascularized free fibular flap by performing a peroneal-brachial arteriovenous anastomoses and fixating with a long proximal LCP plate, as well as the surgical technique description as a reference for further cases in which surgeons encounter this kind of challenges.
Keywords: autologous vascular free fibular flap, humerus non-union fracture, great bony defect, mulitreate fracture, pseudoarthrosis.
Presentación del caso.
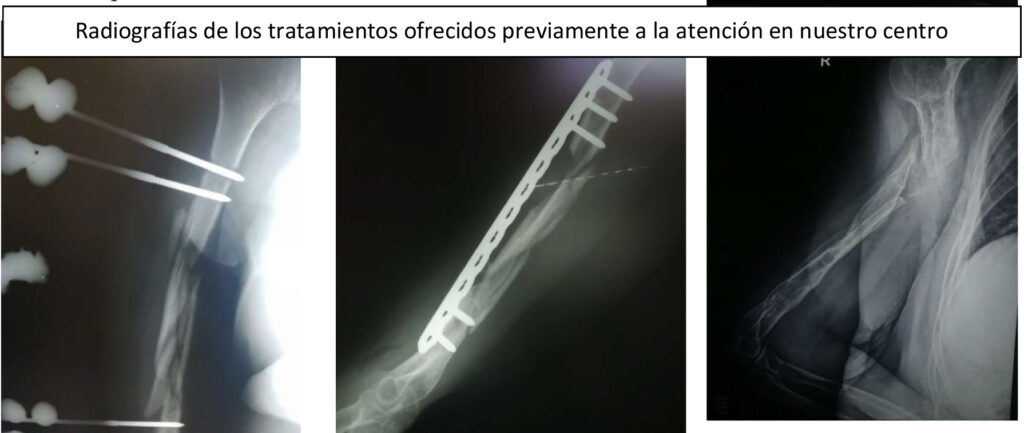
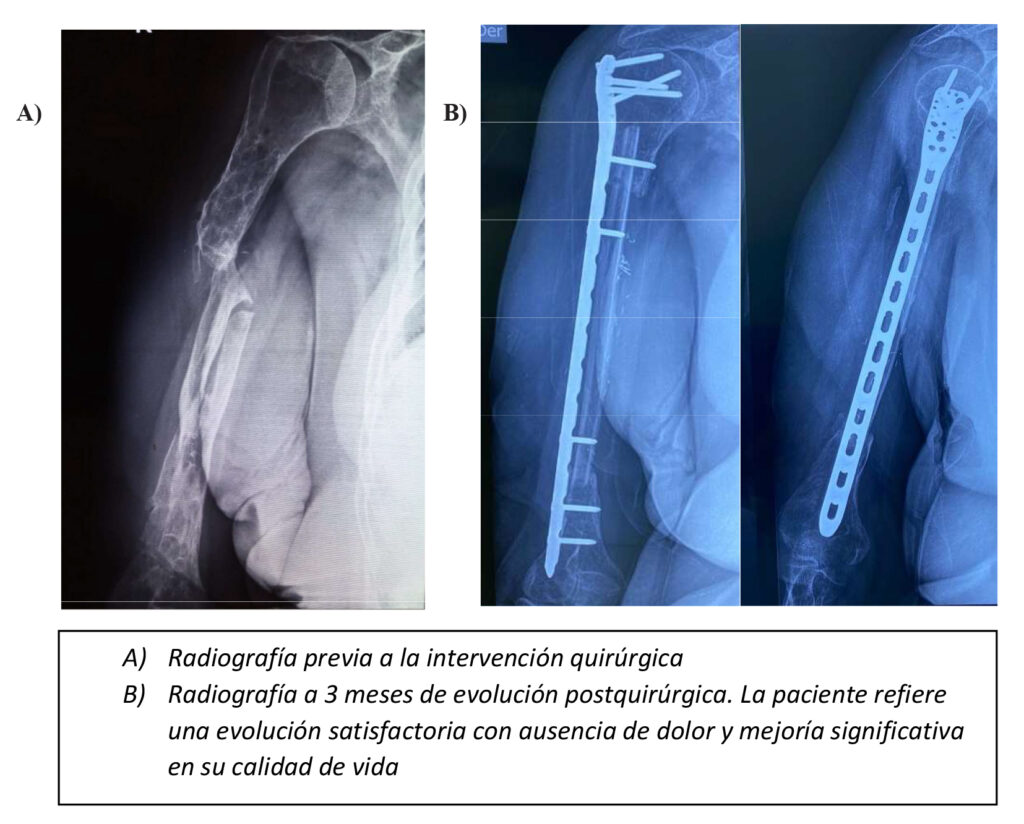
Paciente femenino de la sexta década de la vida con antecedente de fractura diafisaria de humero derecho multifragmentada en un accidente automovilístico 7 años previos. Se le coloca un fijador externo como tratamiento definitivo inicial y posteriormente uso de ortesis de sarmiento sin datos de consolidación después de más de un año. Se opera después de dos años con una placa LCP de húmero proximal, después de más de 2 años la paciente continúa con dolor y se retira material intentando colocar clavo centromedular (CCM) de húmero el cual falla en el mismo acto quirúrgico por lo que se decide dejar sin material y se coloca ortesis de sarmiento el cual lleva la paciente por más de 3 años con dolor y limitación funcional, para terminar con su dolor le ofrecen amputación de la extremidad o continuar en esas condiciones. Por lo que acude al centro de cirugía ortoplástica para una segunda opinión donde se le ofrece reconstrucción con autoinjerto de peroné libre vascularizado fijado con placa LCP de húmero proximal larga. En ningún momento presentó lesión del nervio radial.
Indicaciones del injerto de peroné libre vascularizado:
Reconstrucción del miembro torácico con defectos mayores a 6cm resultado de resección oncológica, osteomielitis, no unión, trauma o anormalidades congénitas. También es útil en pérdidas óseas más pequeñas con pérdida cutánea.
Artrodesis de muñeca y de hombro después de extirpación tumoral.
Para brechas óseas de cualquier tamaño donde otros injertos han fallado y cuando predomina el defecto vascular.
Contraindicaciones
Relativo en enfermedad ateroesclerótica del miembro pélvico.
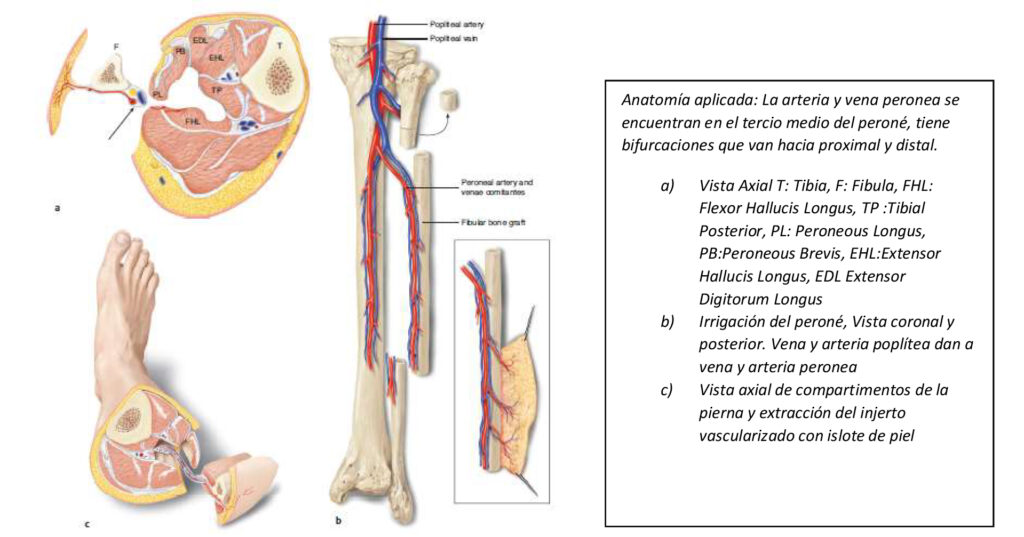
5-7% de los pacientes presentan irrigación única por la arteria peronea en dicho caso se puede usar la contralateral o injerto venoso después de las extracción de la arteria peronea.
Técnica quirúrgica
Es ideal que se tengan 2 equipos quirúrgicos, especialistas en microcirugía reconstructiva y en ortopedia, para disminuir el tiempo quirúrgico y disminuir el riesgo de complicaciones.
Se sugiere isquemia con 300-350mHg en el muslo sin vaciamiento o vaciamiento parcial para poder visualizar las perforantes cutáneas más fácilmente. Se recomienda el uso de lupas quirúrgicas. Se coloca un bulto debajo de la zona glútea y flexión de la rodilla a 90°.
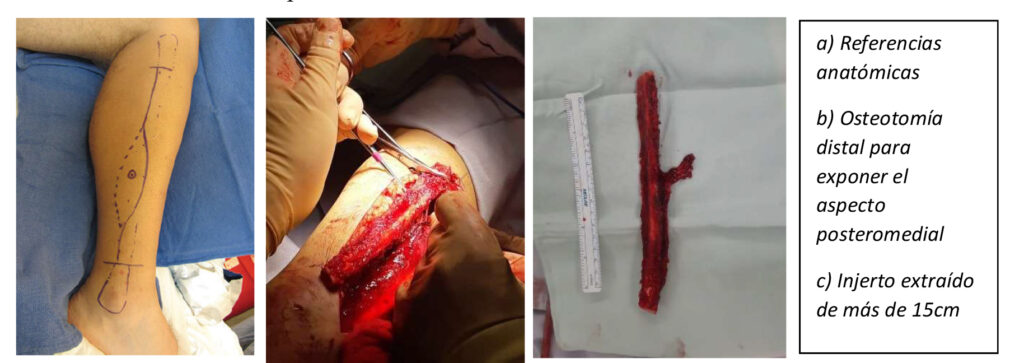
Referencias: se marca cabeza del peroné, maléolo lateral, bordes anterior y posterior del peroné, se deja un margen proximal y distal de por lo menos 7cm ya que esto evitará inestabilidad de tobillo o rodilla, y en caso de pacientes pediátricos se puede colocar un tornillo transindesmal.
El abordaje puede ser lateral o posterior como describe originalmente Taylor en 1974, el borde posterior del peroné corresponde al septum intermusclar posterior y se puede identificar al palpar los músculos peroneos.
Si se requiere injerto de piel debe ser entre el tercio medio y tercio distal (más vascularizado) con su centro en el borde posterior del peroné como se muestra en la imagen (a). Se debe poner especial cuidado a no dañar el paratendon de los músculos peroneos, estos se retraen anteriormente sin dañar el periostio del peroné y con atención de no dañar el nervio peroneo superficial proximalmente.
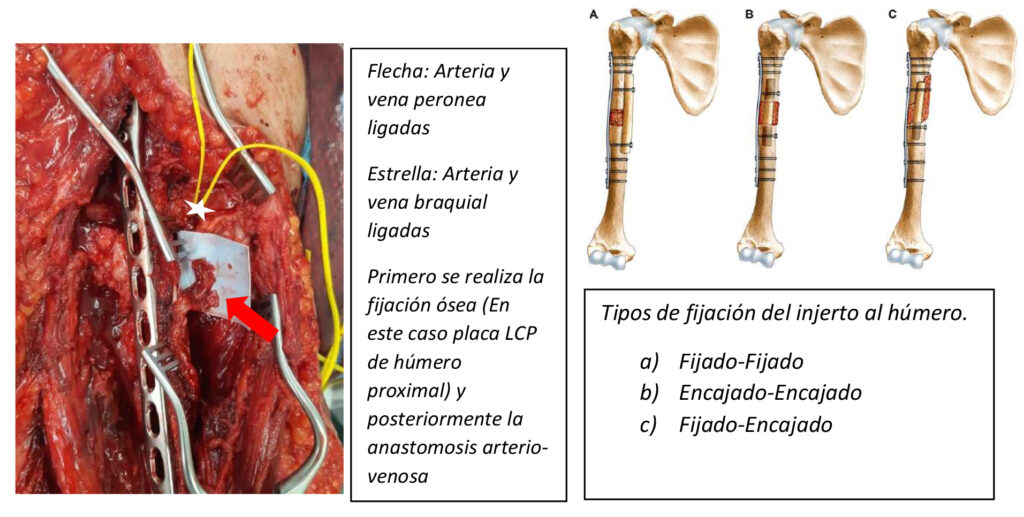
Primero se realiza la osteotomía distal ya sea con sierra de Gigli o eléctrica, se desperiostiza solo la parte final del peroné y se colocan con cuidado separadores romos para no dañar los vasos, la osteotomía distal facilita la rotación y exposición del paquete vascular para su disección cuidadosa, se ligan las arteria y vena peronea lo más proximal posible y finalmente se realiza la osteotomía proximal para obtener el injerto
Una vez adquirido el injerto con previa planificación preoperatoria de la longitud del defecto se puede configurar de diferentes maneras: Como injerto intramedular al húmero, fijado por fuera de éste o se puede dividir como doble barril al osteotomizar transversalmente y respetando la arteria y vena peronea, aumentando así el diámetro de acuerdo a las necesidades.
Para abordar el húmero se puede realizar un abordaje lateral, anterolateral ampliado o incluso medial para localizar el paquete vascular braquial.
Se puede fijar el injerto con placa LCP con 3 tornillos bloqueados proximales y 3 distales, respetando 3 a 4mm del injerto para no alterar su vascularización (no comprimir el periostio)
Se pueden colocar tornillos adicionales que fijen el peroné con el húmero teniendo cuidado de no dañar la vascularización del injerto.
En caso de presencia de infección se recomienda fijador externo
Se puede añadir injerto autólogo de cresta iliaca (esponjoso) entre el húmero y el trasplante para aumentar el éxito en la integración del mismo.
Después de la fijación se realiza la anastomosis vascular con Nylon 8 o 9-0 de la arteria y vena peronea con arteria y vena braquial con cuidado de evitar que se comprima el pedículo por el músculo bíceps o braquial.
Cuidados postoperatorios
En el postquirúrigco inmediato se indica tromboprofilaxis, se sugiere un dispositivo Doppler para monitoreo las primeras horas. Se recomienda inmovilización por 2 a 3 semanas. Retiro de puntos a partir de las 2 semanas.
La unión radiográfica se presenta a partir de los 5 meses y hay hipertrofia del peroné a los 12 meses y no se presenta fractura por estress del injerto al seguimiento a un año, en las series de casos consultados no se presentaron complicaciones neurovasculares ni del miembro torácico ni en el sitio donador.
Resultados
A los 3 meses de postquirúrgico el paciente presenta una puntuación en el cuestionario DASH Score (Hombro, codo y mano) de 58.3/100 puntos, sin embargo cabe destacar que la paciente tuvo mucho tiempo inmovilizada y a la exploración física se identifica capsulitis adhesiva del hombro la cual requiere tratamiento, tiene dolor ocasional de 2/10 de EVA (Escala Visual Análoga) que no requiere analgésicos con arcos de movimientos con abducción de 100 grados extensión de 110 grados flexión del codo de 100 grados. La integración completa del injerto se identificaría hasta los 6 meses posquirúrgico e hipertrofia radiográfica se apreciaría hasta los 12 meses.
Hay una notoria satisfacción en la calidad de vida de parte de la paciente a pesar de aun tener ciertas limitaciones que requieren su tratamiento específico.
No se presentaron complicaciones vasculares o nerviosas ni en el miembro torácico ni en el sitio donador.
Discusión
El éxito en el tratamiento de estos pacientes comienza por seleccionar correctamente el caso de acuerdo a las indicaciones. Se considera que se debe hacer un estudio Doppler o angiografía del miembro pélvico donador previo a la cirugía para evitar complicaciones vasculares.
Aquellos pacientes que han fallado a otros tratamientos previos con una buena expectativa funcional son excelentes candidatos, sobre todo aquellos con defectos mayores a 6cm en cuyo caso otro tipo de injerto podría ser insuficiente, en especial aquellos cuya falla en el tratamiento está dada por una vascularización deficiente.
Los injertos no vascularizados son menos confiables en defectos mayores a 6cm sobre todo cuando la vascularización es pobre.
La discrepancia de los miembros torácicos no parece ser un problema y en cuyo caso se podría evitar con una adecuada planeación preoperatoria
Hay que tener en cuenta que para la complejidad del procedimiento es necesario que sea realizado por cirujanos expertos capacitados en microcirugía reconstructiva, con el equipo necesario.
Conclusiones
El presente documento sirve para evidenciar una técnica quirúrgica disponible para ampliar el repertorio de soluciones para casos difíciles y con evidencia de buenos resultados.
En el caso de nuestro paciente es necesario llevar un programa de terapia física para mejorar aún más los arcos de movimiento ya que estuvo años inmovilizada y hay presencia de artrofibrosis en hombro y codo.
La mejoría en su calidad de vida se ve evidenciada por la importante disminución del dolor, la estabilidad de su miembro torácico sin depender de una ortesis, con aumento en los rangos de movimiento que le permite realizar funcionalmente las actividades de la vida diaria.
Es necesario tener una muestra más grande de pacientes con seguimiento a mediano y largo plazo para poder hacer una evaluación más objetiva del éxito en este tipo de tratamientos, así como las posibles complicaciones.
El presente caso tiene la intención de fomentar esta técnica y así aumentar la serie de casos para demostrar que su efectividad sea estadísticamente significativa cuando está indicado y poder ofrecer más opciones a nuestros pacientes.
Conflicto de intereses
Sin conflicto de intereses
Agradecimientos
A todos los pacientes que ponen su confianza en el centro de cirugía ortoplástica.
El servicio de traumatología y ortopedia del Hospital General Regional 45 del IMSS Guadajalara, Jalisco, México.
Referencias
[1]David J S. The art of microsurgical recontruction 2013, p 269-277 Free fiular flap
[2] Volgas DA, Stannard JP, Alonso JE. Nonunions of the humerus. Clin Orthop 2004;419:46—50.
[3] Mast JW, Spiegel PG, Harvey JP, Harrison C. Fractures of the humeral shaft. A retrospective study of 240 adult factures. Clin Orthop 1975;112:254—62.
[4] Gonzalez del Pino J, Bartolome del Valle E, Lopez Grana G, Ferreira Villanova J. Free vascularized fibula grafts have a high union rate in atrophic nonunions. Clin Orthop 2004;419:38—45.
[5] Jupiter JB, von Deck M. Ununited humeral diaphyses. J Shoulder Elbow Surg 1998;7:644—53.
[6]Taylor GI, Miller GD, Ham FJ. The free vascularized bone graft. A clinical extension of microvascular techniques. Plast Reconstr Surg 1975;55(5):533–544 PubMed
[7]. Chen ZW, Yan W. The study and clinical application of the osteocutaneous flap of fibula. Microsurgery 1983;4(1):11–16 PubMed
[8] Yajima H, Tamai S, Ono H, Kizaki K. Vascularized bone grafts to the upper extremities. Plast Reconstr Surg 1998;101(3):727–735, discussion 736–737 PubMed
[9] Jupiter JB, Gerhard HJ, Guerrero J, Nunley JA, Levin LS. Treatment of segmental defects of the radius with use of the vascularized osteoseptocutaneous fibular autogenous graft. J Bone Joint Surg Am 1997;79(4):542–550 PubMed
[10] Heitmann C, Erdmann D, Levin LS. Treatment of segmental defects of the humerus with an osteoseptocutaneous fibular transplant. J Bone Joint Surg Am 2002;84-A(12):2216–2223 PubMed.
[11] Muramatsu K, Doi K, Ihara K, Shigetomi M, Kawai S. Recalcitrant posttraumatic nonunion of the humerus. Acta Orthop Scand 2003;74:95—7.
[12] Scheck M. Surgical treatment of nonunions of the surgical neck of the humerus. Clin Orthop 1982;167:255—9.
[13] Toh S, Tsubo K, Nishikawa S, et al. Long-standing nonunion of fractures of the lateral humeral condyle. J Bone Joint Surg 2002;84A:593—8.
[14] Taylor GI, Miller GD, Ham FJ. The free vascularized bone graft: a clinical extension of microvascular techniques. Plast Reconstr Surg 1975;55(5):533—44.
[15] Yajima H, Tamai S, Ono H, Kizaki K. Vascularized bone grafts to the upper extremities. Plast Reconstr Surg 1998;101(3):727—35.
[16] Gilbert A. Vascularized transfer of the fibular shaft. Int J Microsurg 1979;1:100—2.
[17] Masquelet AC, Begué T. The concept of induced membrane for reconstruction of long bone defects. Orthop Clin North Am 2010;41(1):27—37 [table of contents].
[18] Zappaterra T, Ghislandi X, Adam A, Huard S, Gindraux F, Gallinet D, et al. Induced membrane technique for the reconstruction of bone defects in upper limb. A prospective single center study of nine cases. Chir Main 2011;30(4):255—63 [Epub 2011 Jul 6. French].
[19] Pinsolle V, Teissier R, Casoli V, Martin D, Baudet J. The pedicled vascularised scapular bone flap for proximal humerus reconstruction and short humeral stump lengthening. J Plast Reconstr Aesthet Surg 2007;60(9):1019—24 [Epub 2007 May 11].
[20] Sakai K, Doi K, Kawai S. Free vascularized thin corticoperiosteal graft. Plast Reconstr Surg 1991;87(2):290—8.
[21] Johnson EE, Urist MR, Finerman GA. Resistant nonunions and partial or complete segmental defects of long bones. Treatment with implants of a composite of human bone morphogenetic protein (BMP) and autolyzed, antigen-extracted, allogeneic (AAA) bone. Clin Orthop relat Res 1992;277:229—37.
[22] Bong MR, Capla EL, Egol KA, Sorkin AT, Distefano M, Buckle R, et al. Osteogenic protein-1 (bone morphogenic protein-7) combined with various adjuncts in the treatment of humeral diaphyseal nonunions. Bull Hosp J Dis 2005;63(1—2):20—3.
[23] N. Kerfant et al. Free vascularised fibular graft in multi-operated patients for an aseptic non-union of the humerus with segmental defect: Surgical technique and results. Orthopaedics & Traumatology: Surgery & Research (2012) 98, 603—607.


No responses yet